摘 要:酶是一种高效、专一、反应条件温和的生物催化剂,其工艺具有节能、环境污染小等特点,因而在纺织工业中获得了广泛的应用。文中全面阐述了酶制剂的基本特性,酶的动力学性质,酶活力的测定方法,纺织加工条件对酶制剂稳定性的要求,以及酶制剂复配原理等;介绍了纤维素酶、蛋白酶、淀粉酶、水解酶和氧化还原酶在印染工业中应用的基本原理和生产工艺,以及纺织生化处理技术的最新发展。 关键词:染整工业;酶;应用
中图分类号: TS190·2 文献标识码: A 文章编号: 1000-4017(2010)19-0035-05
1 酶制剂的基本特性
地球上的生物形形色色,种类繁多。但不管生物如何多种多样,其生命的延续都离不开一种神奇的物质———酶。几乎所有的生命活动,从动物到植物,从参天大树到微生物,都需要酶来参与。酶的利用可以追溯到数千年前,但酶的本质直到20世纪初才逐渐被认识,这才促进了生物酶从生命科学、食品工程领域逐渐向其它领域尤其是工业领域的应用。以酶制剂应用为主要手段的工业技术被认为是“绿色”工艺,是最具发展潜力的技术之一。
1.1 酶的特性
要了解什么是酶,就必须了解以下几个对酶的描述。酶是一种特殊的催化剂[1, 2]。催化剂是一类能改变反应速度,但不改变反应性质、反应方向和反应平衡点,而且反应完成后其本身不发生变化的物质。例如,蛋白质水解为氨基酸,淀粉水解为葡萄糖,就热力学性质而言,这些反应完全能够自发进行,甚至可以达到彻底水解的程度,但在没有催化剂的情况下,反应进行得极为缓慢,而少量的酸、碱和酶都可以在这些反应中起到催化作用,加速反应进行。
酶和无机或有机催化剂相比,具有如下特点:
(1)高催化效率
在可比的情况下,相对于其它非生物酶催化剂,酶的催化效率高达107~1012倍,某些酶甚至可加快反应速率高达1014倍。
酶的这种高催化效率是因为酶能够显著降低反应过渡态能量。对于一个化学反应,通常首先形成一个对底物(反应物)和产物双方来说,在能量上都不稳定的化合物,这个不稳定的中间结构叫做过渡态。图1是三种反应过渡态的能量关系示意图。
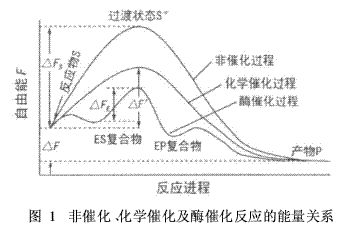
图1中,ΔF是底物和产物之间自由能之差,是该反应的最终自由能变化;ΔFS和ΔF′分别表示非催化反应和化学催化反应过程中过渡态与底物之间的自由能之差;ΔFE为酶催化反应过程中过渡态与酶及底物络合物之间的自由能之差。它们分别表示各自反应能量壁垒,即底物转变到产物之前必须具备的最小能量(活化自由能)。
通常,对一个反应来说,存在ΔFS>ΔF′ ΔFE的关系,即酶促反应使活化能大大降低。例如双氧水的分解反应,在无催化剂存在时,活化能为75. 31 kJ/mo;l用钯作催化剂,活化能为48. 99 kJ/mo;l而用酶作催化剂时,活化能仅为8. 37 kJ/mol。根据Arrhenius方程,反应速率K和反应活化能E具有下列关系:

式中:R———气体常数;
A———频率因子;
T———绝对温度。
因而,活化能E越小,反应速率越快。对于过氧化氢酶来说,在30~50℃(过氧化氢酶的最适温度)条件下,双氧水分解的酶促反应速度是无催化反应速率的6. 78×1010~3. 51×1011倍,是钯催化反应的6. 06×106~1. 14×107倍。
由此可见,酶催化反应的活化能显著降低,是酶促反应具有极高效率的关键。其机理有多种解释,主要为:邻近和定向效应、底物变形、酸碱催化反应、亲核和亲电催化反应以及反应微环境的影响等,具体可以参见相关文献。
(2)高度的专一性
酶的专一性是指一种酶只能催化一种或一类结构相似的底物进行某种类型反应的特性。催化反应的专一性是酶最重要的特性之一,是酶与其它非酶催化剂最主要的不同之处。
酶的专一性可以用多种模型来描述,最著名和形象的是锁和钥匙模型,如图2(a)所示,由Fisher在1894年提出。该模型表示酶分子结构在形状上是固定的、不可形变的,这意味着如果酶分子构象发生微小变化,自然就破坏了酶和底物的契合关系,使催化反应不能进行。这与越来越多的实验事实不符。
1958年Koshland提出了诱导契合理论[图2(b)和2(c)], 1963年Monod等人提出了变构模型。这些模型表明酶的活性部位是柔性可变的,甚至通过酶的化学修饰,可以改变或增进酶的活性。尽管如此,酶的锁和钥匙模型因为简明直观,目前仍然用于描述酶和底物的高度专一特性。
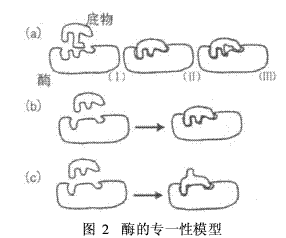
(a)锁和钥匙模型 (I)酶的活性部位与底物不相配; ( II)酶的活性部位与底物高度相配,可以催化化学反应; ( III)酶的活性部位与底物相配较低,不能高效催化化学反应。
(b)诱导契合模型(效应) 在此模型中,底物可以诱导酶的活性部位发生变形,使活性部位与底物结构相配,完成化学反应。
(c)变构模型 酶的活性部位也可以使底物发生变形,使底物与酶的活性部位结构相配,完成化学反应。
不同酶的专一性程度是不同的,有以下几种[1, 2]:
①化学键专一性。此类酶的催化作用只要求化学键相同,是属于专一性程度很低的酶,如肽酶、磷酸(酯)酶和酯酶等,可以作用于很多底物。生物分子降解,尤其应用于纺织工业中的水解酶,大多为此类低专一性的酶,这是因为相对较低的专一性对于降解更为经济。低专一性的酶在合成酶中很少见。
②基团专一性。这种为中等程度的专一性。大多数酶呈绝对或几乎绝对专一性,它们只催化一种底物进行快速反应,如脲酶只催化尿素水解成二氧化碳和水,或以很低的速率催化结构非常相似的类似物。
③立体异构专一性。当酶作用的底物和形成的产物含有不对称碳原子,即酶只能作用于一种异构体。立体异构专一性是酶催化反应的一个显著特点。
④反应专一性。一种酶只能催化某化合物在热力学上可能进行的许多反应中的一种反应。
酶催化反应专一性程度还与酶的个体有关。酶的专一性有利于节约成本,提高产物的纯度,为工业化生产带来便利。如淀粉酶用于葡萄糖的生产,可减少30%的水蒸气、50%的灰分和90%的副产物。工业化淀粉酶的成功上市,使酸法葡萄糖生产完全被酶法所替代,实现了葡萄糖生产的飞跃。
(3)反应条件温和
酶来自生物体,因而一般酶催化反应均为非极端条件,除个别酶种外,均可在常温常压条件下进行,有利于生产控制,并可节约能源,降低设备成本。另外,酶催化反应都在弱酸、弱碱或中性条件下进行,对环境污染小,对设备的腐蚀轻,生产安全性高。
酶的活性还受一些化合物调控。有些酶如胰凝乳蛋白酶在表现活力时不需要任何辅助因子,但大多数酶需要非蛋白组分即辅助因子的存在才能表现活力。辅助因子大体可以分为两大类,即有机辅助因子和金属离子。在现有的酶中,大约有1/3需要金属离子存在才能保持活性,其中一类在酶分子结构中就带有一个或几个金属离子,这类酶称为金属酶;另一类需要另加金属离子或金属配体后才具有活性,这种酶称为金属活化酶。
1.2 酶的活性部位
酶的活性部位由酶分子中少数几个氨基酸侧链基团构成。活性部位在酶分子表面上通常表现为一个深陷的“凹槽”或“凹坑”,以容纳底物的被催化部位。某些特殊的酶还可能是一种微管结构,如纤维素合成酶。图3为酶“凹坑”活性结构的示意,当肽键的羰基侧为丙氨酸残基时,由于丙氨酸侧基为甲基,不能深入到酶“凹坑”底部,因而不能水解该肽键;反之对于赖氨酸残基,由于赖氨酸具有含氨基的长侧基,可以深入到“凹坑”底部和酶活性部位产生配合作用,因而可以产生水解作用,表现出酶活力的特异性。
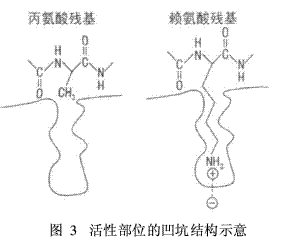
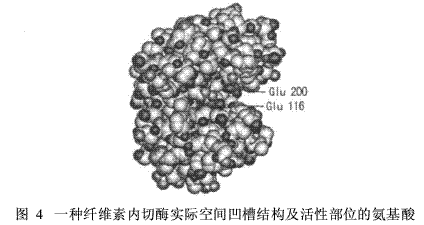
图4所示为一种纤维素内切酶的空间结构。其活性部位的形状为凹槽结构,并由一级结构中116位和200位的谷氨酸(Glu)构成活性部位。
就功能而言,活性部位的几个氨基酸侧基又可以分为底物的结合部位和催化部位[4]。底物的结合部位是与底物特异结合的部位,因此也叫特异性或专一性决定部位。催化部位直接参与催化,底物的敏感键在此部位被切断或形成新键,并生成产物。底物的结合部位和催化部位的区分并不是绝对的,有的基团具有结合底物和催化底物反应双重功能。从现有结构比较明确的酶来看,一条肽链的单功能酶只有一个活性部位。
构成酶催化部位的基团由氨基酸侧基提供,如丝氨酸的羟基、半胱氨酸的巯基、组氨酸的咪唑基、天门冬氨酸和谷氨酸的羧基及赖氨酸的ε-F氨基等。催化活性部位通常由2~3个此类氨基酸组成[2]。
不同类型的酶,活性部位的深凹形有明显差异。以水解酶来说,内切酶是长形凹槽,如溶菌酶凹槽的大小恰好能容纳多糖底物的六个单糖;而外切酶则表现为疏水口袋,如羟基羧肽酶A的疏水口袋就由Zn2+,His-69,His-196, Glu-72, Arg-145,Tyr-248,Glu-270,Tyr-198, Phe-279,Arg-71等基团组成(His为组氨酸,Glu为谷氨酸, Phe为苯基丙氨酸,Arg为精氨酸,Tyr为酪氨酸)。底物必须以正确的方式与活性部位结合,才能顺利地被水解。酶活性部位的大小往往是底物大小的函数。对于大分子底物,如淀粉、蛋白质和核酸分子,它们与酶之间可能存在很多的相互作用部位。即使如此,酶肽链的绝大部分仍然不能直接和底物接触,但这些非活性部位肽链起着维持活性部位的构象,即将所有基团保持在活性部位最佳位置的作用[3]。
由于酶的特异性取决于活性部位几个关键氨基酸残基的侧基,而溶液的pH值状态也会影响这些氨基酸残基侧基的解离状况,从而影响酶的活力,因而酶都具有最佳活力pH值条件。同时,由于酶是蛋白质,随着温度升高其稳定性下降,使酶的失活速率增加;另一方面,根据热力学原理,温度升高又会使酶的催化效率增加,因而酶还有一个相对最佳活力温度。该活力温度实际上是酶作用时间的函数。
1.3 酶的分类和命名[1,2]
现在已知的酶有3 000多种。为了准确地识别某一种酶,避免发生混乱和误解,在酶学研究和酶工程领域要求对每一种酶都要有准确的名称和分类。
根据国际酶学委员会(Enzyme Commission, E. C. )的决定,区分酶专一性的基本依据是它们催化的反应,据此将已知酶的催化反应分为六大类:
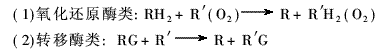
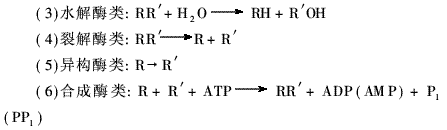
在每一大类下,根据反应类型又可分成若干小类,其中在纺织工业中应用和研究的主要为水解酶、氧化还原酶和合成酶。
国际酶学委员会推荐了一套酶的系统命名法。通常每个酶都有一个系统名和推荐的俗名(习惯名)。由系统名可以确定每个酶的催化反应类型,它一般由酶催化的底物名称加上该酶所属大类名称组成,如蛋白酶和蛋白水解酶,前者为俗名,后者为系统名。如果是双底物反应,则两个底物都要列出,并由冒号隔开。英文的酶名都以“ase”作后缀。
除此之外,每个酶都有一个四位编号(标码)。编号前三位数字表示所属的大类、亚类和亚亚类,根据前三位标码可判断酶催化类型和催化性质;第四位数字则表示该酶在亚亚类中的序列号,根据这四个数字就可以确定具体的酶。如胰蛋白酶的编号为E.C. 3. 4. 21. 4。对于催化同一反应的不同酶,则有相同的前三位号码,只是在第四位号码上不同。
酶学委员会还建议,在发表论文时,酶在第一次被提到时应写出它的标码、系统名和来源,然后再用系统名或习惯名叙述。
1.4 酶的生产
1. 4. 1 酶的主要生产方法[1, 2]
酶的生产方法可分为提取法、发酵法和化学合成法三种。
提取法是最早采用的酶生产方法,现仍在使用。例如,从动物胰脏提取胰蛋白酶、胰淀粉酶、胰脂肪酶和这些酶的混合物———胰酶;从木瓜中提取木瓜蛋白酶。提取法简单方便,但含酶组织生产时会受气候和地理环境影响,而且产品含杂多,分离纯化也比较困难。
发酵法是20世纪50年代以来酶生产的主要方法。该法是利用细胞主要是微生物细胞生命活动来获得人们所需要的酶。目前,工业应用的酶主要来源于微生物。这是因为微生物种类多,所有的酶几乎都能从微生物中找到。而且微生物易于培养,只要简单的设备和一般的原料培养基,就能迅速繁殖,获得大量的酶。
目前研究的还有酶的化学合成生产法。自1969年美国首次用化学合成法得到含有124个氨基酸的核糖核酸酶以来,经过许多科学家的努力,现在已经可以用肽合成来进行酶的化学合成。然而,由于合成需要的各种氨基酸纯度要求极高,成本高昂,而且只能合成那些已知化学结构的酶,这就使得化学合成法受到极大的限制,至今仍停留在实验阶段。
1. 4. 2 工业酶制剂生产开发的重点
(1)工业用酶制剂的复配加工[2]
酶制剂的复配加工,已经成为商业酶制剂生产的重要内容。作为工业酶制剂,酶作用的条件已经发生了很大变化,并具有自身的特点。不同的纺织企业,由于生产产品、加工对象和设备条件不同,对纺织酶制剂的要求不尽相同。事实上,世界上著名专业酶制剂生产厂商提供的商业酶制剂中含有多种
添加组分,以维持酶制剂的性能稳定,并形成了系列产品,以满足不同加工要求。另外,这些公司除直接供应用于纺织生产的酶制剂外,还为纺织助剂公司、某些大企业提供高浓度的酶制剂用以复配。为了满足特定工艺条件,企业在购得酶产品后,也通常要进行复配。
(2)基因改性酶制剂的生产[4]
发酵法生产酶制剂的关键是菌种的保存。一个专业酶制剂生产商,其核心技术之一是如何长期保存菌种,并使菌种的类型在长时间内不会产生改变:
①冷冻保存
通常可在-5~-20℃条件下保存两年。如需保存更长时间,温度必须控制在-50~-80℃。另外,还可以在液氮条件下进行长期保存。液氮保存被认为是长期保存菌种的最佳方法。
②冷冻干燥法
冷冻干燥是将冷冻细胞通过降压升华而去除水分的方法。大多数菌株用该方法可保存10年。
③传代培养
通过不定期将菌株移植到新鲜琼脂上,在合适的生长温度下培养,然后将培养菌株放入5℃的冰箱中贮存。这种方法方便、经济,但不适合长时间保存。
目前,酶制剂生产的主要工作是改善酶制剂生产菌,使菌种在发酵过程中提高酶的产量,减少或去除杂酶和其它代谢产物,降低发酵成本等。因此,生产菌的基因改性和重组成为目前酶制剂经济高效生产的重点。传统方法是将菌种放在强基因诱变环境下筛选变异菌。这种方法也就是所谓的基因突变,其历史可追溯到20世纪30年代Thom和Steinberg的研究。该方法在20世纪40年代在青霉素生产上获得成功,从而得到迅速发展。常见的基因诱变环境为紫外、X射线、γ射线辐射,采用化学制剂及太空环境等。在这种环境中成活的菌种被分类和观察酶制剂生产的改善情况。在20世纪50~70年代,对于特定的酶生产采用这种方法,其产酶性能得到3~6倍的改善,大大促进了酶制剂工业的发展。
酶制剂的生产在20世纪70年代因基因工程和基因重组(recombinantDNA, rDNA)技术的发展获得重大飞跃。采用这些技术,对特定酶的特定基因密码进行分离、纯化,并在相应菌种中进行着重表达,可使酶制剂的产量和纯度得到很大提高。大肠杆菌是首先进行基因重组研究的菌种,随着技术的进步以及基因重组在商业、工业中的巨大应用价值的体现,在20世纪80年代人们对具商业应用价值的菌种,如曲霉(Aspergillus ni-ger)、木酶(Trichoderma)和枯草杆菌(Bacillus subtilis)等,进行大规模的基因克隆。第一个用基因重组(菌种)技术生产的食品级酶制剂为α淀粉酶,并由CPC国际公司向美国食品和药品管理机构(Food and DrugAdministration,简称FDA)提交了生产许可申请。随后,基因重组技术逐渐为大多数酶制剂公司接受并成为酶制剂生产开发的主要手段。表1为当前商业上可以获得的基因工程改性酶制剂产品,其中淀粉酶、纤维素酶和木聚糖酶都是在纺织工业中可以应用的酶制剂,在后文中将作详细介绍。菌种是酶制剂生产企业的核心技术,对外严格保密。即使是同一菌种生产的酶制剂,其性能也可能差异很大。

基因重组技术用于酶制剂生产开发有诸多优势,主要表现在[4, 5]:
①通过基因改性菌生产的酶制剂可比初始菌纯得多。在食品工业中,纯的酶制剂可以更好提高食品加工后的性能,如在面包制作中通常需要添加淀粉酶和戊聚糖酶。目前,通过基因重组技术生产的这两种酶已经完全没有蛋白酶的活力。由于对面粉中的面筋不会产生额外的水解,面粉的韧性得到较好保持。在纺织工业加工过程中,酶的纯度也特别重要。
②通过基因改性菌生产的酶制剂,其产量可大幅提高,这也意味着降低了生产成本。
③通过基因重组技术生产可以商业化应用的特定酶制剂,理论上已经可行。最好的例子是凝乳酶的生产。凝乳酶最早发现在小牛的胃中,目前已经可以通过微生物发酵进行生产,其原因就是牛的基因片段在曲霉和Marxianus var产乳糖酶酵母中被成功表达(Maxiren TM)。
④基因的表达系统又叫“嵌入(plug-in)”系统,在这种系统中可以将基因片段有选择地嵌入到目标菌种中,使酶的性能得到提高,且较为经济。这意味着在同一菌种的同一产酶系统中,可以生产不同种类的酶,其商业应用价值显而易见。尽管如此,对基因改性酶(食品)在食品领域的应用目前还是持谨慎态度,而其在非食品领域得以快速发展,如纺织、造纸和浆粕生产等。毫无疑问,基因重组技术是酶制剂生产的发展方向。
基因突变、基因重组技术已成为生产性能优良、活力稳定、具有宽域使用性能纺织酶制剂的有效手段,如目前生产的退浆淀粉酶,已经可以在110℃的高温下使用。基因改性生产新型酶制剂是目前酶制剂生产重点,也是发展方向。
(3)固定化酶的开发应用尽管酶的应用越来越广泛,但在酶的使用过程中,人们也注意到酶的一些不足。具体表现在:
①酶的稳定性较差。在温度、pH值和无机离子等外界因素作用下,酶容易变性失活。
②普通的酶都是在水溶液中与底物反应。反应体系中,酶与底物和产物混在一起,反应结束后,即使酶仍有较高的活力,也难以回收利用。这种一次性使用酶的方式,不仅成本高,而且难以连续化生产。
③酶催化反应后,酶与杂质、产物混在一起,为进一步分离纯化带来一定的困难。
针对酶的这些不足,人们长期以来一直在寻求改善的方法。固定化技术就是长期研究最有效的成果。
将酶或含酶菌体制成固定化酶或固定化菌体后,由于受到载体和固定化方法的影响,酶的性质将产生变化,如最适温度、最适pH值和底物特异性等,但最重要的是固定化酶的稳定性明显好于游离酶,主要表现在:
①对热的稳定性提高,可以忍受较高的温度;
②保存稳定性好,可以在一定条件下保存较长的时间;
③对蛋白酶的抵抗力强,不易被蛋白酶水解;
④对变性剂的耐受力提高,在尿素、有机溶剂和盐酸胍等蛋白质变性剂的作用下,仍可保持较高活力。
酶的固定化方法很多,但主要是吸附法、截留(包埋法)、结合法、交联法、共价连接法、离子交换法和热处理法等。酶固定化后,酶作用特异性会有所改变,这是由载体的空间位阻引起的。酶固定在载体上后,大分子难以接近酶分子而使催化效率大大降低,固定化酶对大分子产物没有作用或作用效率很低,而对分子质量较小的底物,由于受空间位阻的影响较小或不受影响,催化效率和游离酶无明显区别。
酶的固定化在纺织中有很多潜在的应用价值,如在织物上固定酶,使织物具有生物抗菌效果[6];而氧化还原酶经固定化后,可以作为生物氧漂废水净化、污水(废水)处理的重复使用材料,具有很好的应用前景。
1.5 结语
酶是一种蛋白质,又是一种高效、专一、反应条件温和的特殊催化剂,这种特性决定了其使用方式不同于普通的化学制剂。酶都有一个最佳活性pH值范围,以及与作用时间相关的最佳活性温度范围。酶作为一种生物催化剂,维持其活力稳定是工业应用的关键。近年来随着生物工程的发展,基因重组、基因改性技术的应用,一批活力稳定,活性pH值和温度范围宽,能够满足纺织工业生产应用的酶制剂得到了有效开发,这是酶在纺织工业中得以快速应用的根本原因。
参考文献:略
*请手机端微信扫描或长按识别“产品手册”、“公众号”、“网站”等二维码,可了解各企业系列产品内容!